Драгоценные камни
Самые дорогие и самые ценные вставки. В чем же причина высокой стоимости таких минералов? Разберемся по порядку.
Первое, что нужно учитывать, драгоценные камни – это природные минералы, сложным путем образовавшиеся в земной коре. Соответственно, драгоценный камень может быть назван таковым только при условии его редкой встречаемости в природе.
Украшения с коньячными бриллиантами в коллекции «Шоколад»
Приведем некоторые статистические данные из мировой практики. Относительная стоимость добычи наиболее дорогостоящих камней в процентах от стоимости общей добычи в начале XXI века была следующей: изумруды – 43, рубины – 14, опалы – 10, сапфиры – 6, жадеит – 6, бирюза – 5, прочие цветные камни – 16%. Отсюда видно, что высокая стоимость драгоценных камней обусловлена, в первую очередь, сложностью их добычи.
Какие еще показатели могут выявить драгоценный камень среди всех остальных?
Твердость. Минерал не должен подвергаться внешним воздействиям – царапаться и скалываться. В России, в соответствии с Федеральным Законом «О драгоценных металлах и драгоценных камнях» к такому списку относятся природные алмазы, изумруды, рубины, сапфиры, александриты, жемчуг. К драгоценным камням также приравниваются уникальные янтарные образования.Отсюда видим – его высокая стоимость вполне объяснима.
К тому же, немалую роль при определении цены изделия играет степень его модности. Проще говоря, чем больше аксессуар подпадает под определение «модный тренд», тем выше его стоимость.
Мир драгоценных камней очень велик и, к сожалению, запутан, особенно при поверхностном рассмотрении. На данный момент известно свыше 2,5 тысяч минералов, но только чуть более сотни из них представляют ценность с точки зрения ювелирной промышленности и декоративно-прикладного искусства.
Разобраться в хитросплетении разновидностей драгоценных, полудрагоценных и поделочных камней достаточно сложно, а ведь есть еще и ценные природные образования, минералами не являющиеся. Поэтому в рамках этой публикации будет рассмотрено несколько подходов к классификации ценных минералов и природных образований.
Свойства золота (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Золото |
| 102 | Прежнее название | |
| 103 | Латинское название | Aurum |
| 104 | Английское название | Gold |
| 105 | Символ | Au |
| 106 | Атомный номер (номер в таблице) | 79 |
| 107 | Тип | Металл |
| 108 | Группа | Драгоценный, переходный металл, металл платиновой группы |
| 109 | Открыт | Известно с древних времен |
| 110 | Год открытия | до 6000 года до н. э. |
| 111 | Внешний вид и пр. | Мягкий, тяжёлый металл жёлтого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 3,1·10-7 % |
| 120 | Содержание в морях и океанах (по массе) | 5,0·10-9 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000017 % |
| 124 | Содержание в организме человека (по массе) | 0,00001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 196,966569(4) а. е. м. (г/моль) |
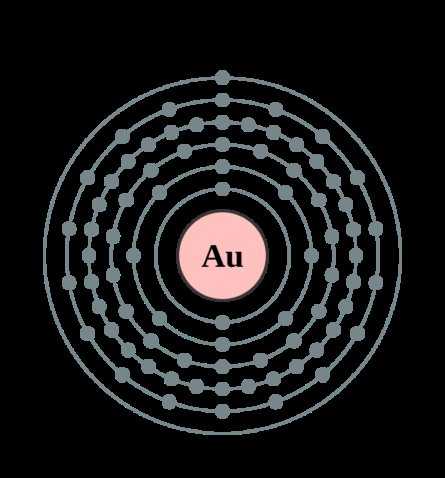
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s1 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O18 P1 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 174 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 136 пм |
| 207 | Радиус иона (кристаллический) | Au+ 151 (6) пм,
Au3+ 82 (4) пм, 99 (6) пм, Au5+ 71 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 166 пм |
| 209 | Электроны, Протоны, Нейтроны | 79 электронов, 79 протонов, 118 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 11-ая группа (по старой классификации – побочная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3, -2, -1, 0, +1, +2, +3, +5 |
| 302 | Валентность | I, II, III, V |
| 303 | Электроотрицательность | 2,64 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 890,13 кДж/моль (9,225554(4) эВ) |
| 305 | Электродный потенциал | Au+ + e– → Au, Eo = +1,692 В, Au3+ + 2e– → Au+, Eo = +1,401 В,
Au3+ + 3e– → Au, Eo = +1,498 В |
| 306 | Энергия сродства атома к электрону | 222,747(3) кДж/моль (2,308610(25) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 19,30 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 17,31 г/см3 (при температуре плавления 1064,18 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1064,18 °C (1337,33 К, 1947,52 °F) |
| 403 | Температура кипения* | 2970 °C (3243 K, 5378 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 12,55 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 342 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,132 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 25,418 Дж/(K·моль) |
| 411 | Молярный объём | 10,2 см³/моль |
| 412 | Теплопроводность | 318 Вт/(м·К) (при стандартных условиях), 318 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 4,0781 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 170 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-57-5 |
Примечание:
205* Эмпирический радиус атома золота согласно и составляет 144 пм.
206* Ковалентный радиус золота согласно и составляет 136±6 пм и 134 пм соответственно.
401* Плотность золота согласно и составляет 19,3-19,32 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 19,3 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления золота согласно составляет 1063,4 °C (1336,55 K, 1946,12 °F).
403* Температура кипения золота согласно и составляет 2856 °C (3129 К, 5173 °F) и 2880 °C (3153,15 K, 5216 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) золота согласно составляет 12,68 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) золота согласно и составляет ~340 кДж/моль и 348,5 кДж/моль соответственно.
410* Молярная теплоёмкость золота согласно составляет 25,39 Дж/(K·моль).
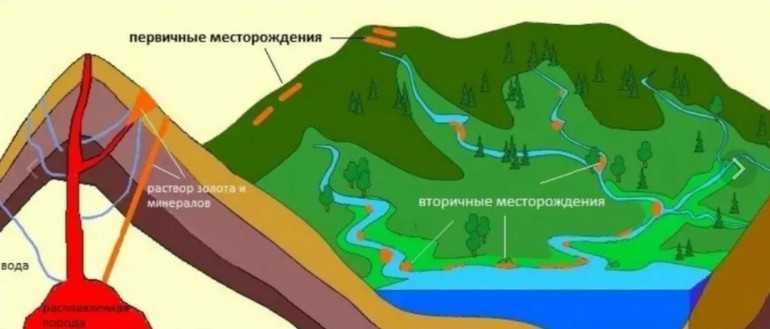
Нахождение в природе
Сегодня элемент золото находящийся в таблице Менделеева не потерял своей актуальности, наоборот представляет огромную ценность для стран всего мира. Геологоразведочные работы по выявлению золотоносных месторождений проводились несколько столетий назад, хотя добыча драгоценного металла началась еще в средневековье.

Добыча, производство и использование природного ископаемого в России проводится в соответствии регламентов законодательства. Поиск месторождений связан с предварительными исследованиями грунта, горных пород, суглинков на наличие спутников золота:
- Отобранные образцы камня, глины проходят проверку в полевых или лабораторных условиях для основательного изучения состава.
- Выявление слоевых плит прозрачного, белого, серого кварца в горных породах, также указывает на содержание драгоценного металла.
- Содержание мышьяка, свинца, цинка в отобранных образцах суглинистого грунта ведет к дальнейшим геологическим разработкам.
В случае нахождения породы с повышенным содержанием элементов золота, геологи занимаются разработкой первичного бурения. После выявления первичных или вторичных месторождений планируется технологический процесс добычи с последующей переработкой полученного сырья.
Первичные месторождения
Образование первичных месторождений связаны с магматическими процессами и выработкой повышенной концентрация золота, происходящей в результате вулканической активности. Магматическое плавление сопровождается остыванием и верхней кристаллизацией выброшенных тугоплавких минералов.
Однако, внутренняя часть застывшей массы, продолжает циркулировать за счет легко плавящихся соединений под воздействием солевых паров. Расплавленная масса проходит через разломы отвердевшей магмы и формирует пласты жил, которые способны входить вглубь земных недр на несколько километров.
Вторичные месторождения
Образование вторичных месторождений связано с процессом разрушения горных залежей под воздействием химического и физического распада. К разрушению слоевых жил ведут:
- температурные перепады;
- воздействие потоков ветра;
- осадки в виде дождя и снега;
- подземные воды рек и озер;
- микроорганизмы, растительность.
Основная роль в перемещении распавшихся пород принадлежит горным ручьям и водным потокам рек. Течение способно размельчить каменные глыбы до уровня песка, образуя в долинах залежи драгоценного металла в неизменном виде.
Сферы применения
- Ювелирное дело: изготовление украшений и посуды, декоративных изделий.
- Чеканка монет, медалей и других наград.
С середины XX века примерно 70% добываемого серебра расходуется промышленностью:
- Электротехника и радиоэлектроника: обработка контактов для увеличения электропроводности; медно-серебряный припой; изготовление катодов в батарейках и аккумуляторах, микросхем и пр.
- Химическое производство: в качестве катализатора при получении оксида этилена и формальдегида.
- Медицина: коллоидные раствора серебра оказывают антисептическое и бактерицидное действие. В стоматологии азотнокислое серебро применяется для лечения кариеса и стерилизации корневых каналов, а также при создании зубных протезов.
- Производство зеркал, деталей для СВЧ-печей, поверхностей некоторых радаров.
- Фотография: изготовление светочувствительных материалов на основе галогенидов серебра.
Чаще всего серебро используется в виде сплавов или соединений.
Добыча
Серебро было известно с глубокой древности (4-е тысячелетие до н. э.) в Египте, Персии, Китае.
Значительным источником извлечённого серебра (не в виде самородков) считается территория Анатолии (современная Турция). Добываемое серебро поступало в основном на Ближний Восток, в Крит и Грецию.
Более или менее значительные данные о добыче серебра относятся к периоду после III тысячелетия до н. э., например, известно, что халдеи в 2500 году до н. э. извлекали металл из свинцово-серебряных руд.
После 1200-х годов до н. э. центр производства металла сместился в Грецию, в Лаврион, недалеко от Афин. Шахты были весьма богаты: их добыча с 600 до 300 года до н. э. составляла около 1 млн тройских унций (30 т) в год. В течение почти тысячи лет они оставались самым крупным источником серебра в мире.
С IV по середину I века до н. э. лидером по производству серебра были Испания и Карфаген.
Во II—XIII веках действовало множество рудников по всей Европе, которые постепенно истощались.
По мере расширения торговых связей, требующих денежного обращения, в XII—XIII веках выросла добыча серебра в Гарце, Тироле (главный центр добычи — Швац), Рудных горах, позднее в Силезии, Трансильвании, Карпатах и Швеции. С середины XIII до середины XV веков ежегодная добыча серебра в Европе составляла 25—30 т; во 2-й половине XV века она достигала 45—50 т в год. На германских серебряных рудниках в это время работало около 100 тысяч человек. Крупнейшим из старых месторождений самородного серебра является открытое в 1623 году месторождение Конгсберг в Норвегии.
Освоение Америки привело к открытию богатейших месторождений серебра в Кордильерах. Главным источником становится Мексика, где в 1521—1945 годах было добыто около 205 тыс. т металла — около трети всей добычи за этот период. В крупнейшем месторождении Южной Америки — Потоси — за период с 1556 по 1783 год добыто серебра на 820 513 893 песо и 6 «прочных реалов» (последний в 1732 году равнялся 85 мараведи).
В России первое серебро было выплавлено в июле 1687 года российским рудознатцем Лаврентием Нейгартом из руд Аргунского месторождения (Нерчинский горный округ). В 1701 году в Забайкалье был построен первый сереброплавильный завод, который на постоянной основе стал выплавлять серебро 3 года спустя. Некоторое количество серебра добывалось на Алтае. Лишь в середине XX века освоены многочисленные месторождения на Дальнем Востоке.
В 2008 году всего добыто 20 900 т серебра. Лидером добычи является Перу (3600 т), далее следуют Мексика (3000 т), Китай (2600 т), Чили (2000 т), Австралия (1800 т), Польша (1300 т), США (1120 т), Канада (800 т).
На 2008 год лидером добычи серебра в России является компания «Полиметалл», добывшая в 2008 году 535 т. В 2009 и 2010 годах «Полиметалл» добыл по 538 т серебра, в 2011 году — 619 т.
Не только украшения
Золото и серебро — основные металлы для украшений. Платина тоже, но это для элиты. А остальные драгметаллы, неужели их необычные свойства не используются — спросит любознательный.
Еще как используются. Вот список областей применения драгметаллов:
- Электротехника. Ее невозможно представить без благородных металлов. Высоконадежные контакты, включая металлокерамические; связь (ну, кто сейчас живет без телефона) невозможна без драгоценных металлов.
- Лабораторная техника, химическое машиностроение. Емкости (от крошечных до настоящих котлов) которые смогут сопротивляться агрессивным кислотам; платиной или ее сплавами с другими драгметаллами покрывают поверхности оборудования в фармацевтической и пищевой промышленности. Интересно: котел, конечно, утащить затруднительно, но в советские времена при использовании в лаборатории тигелька (чашечки) из платины нужно было расписываться в специальном журнале — когда взял, когда вернул. Сама посуда из драгметаллов хранилась в сейфах.
- Медицина. Кто лечился ляписом, протарголом, знайте — вы лечились препаратами серебра. Есть болезни, при которых прописывают растворы золота. Иглы из радиоактивного золота применяют в лечении онкологических заболеваний.
- Защитные покрытия. Драгметаллы применяют в космической промышленности. На наружную поверхность спутников наносят тончайший слой золота (увеличение отражательной способности, защита от коррозии).
- Некоторые благородные металлы (серебро, золото, платина) с успехом работают в качестве катализаторов в нефтяной и химической промышленности.
- Про золотовалютные резервы слышал каждый. Вот там лежит «запас на черный день» у государства. В основном это золото, серебро используется в гораздо меньших количествах.
- Монеты из драгоценных металлов известны давно. Сейчас такие монеты представляют в основном коллекционный или инвестиционный интерес.
- Не будем забывать про ювелирную промышленность. Чистый блеск серебра, томное мерцание золота — это для нас, любимых. Редкая женщина может представить себя без украшения из драгоценных камней и металлов. Для любимого (и очень состоятельного мужа) можно прикупить в подарок авторучку, где перо сделано из сплава осмия, платины и иридия.
Рекомендуем: КОБАЛЬТ — щедрый подарок горных духов
Можно назвать много сфер использования драгоценных металлов. Не считайте их бездельниками-аристократами, не способными ни на что серьезное.
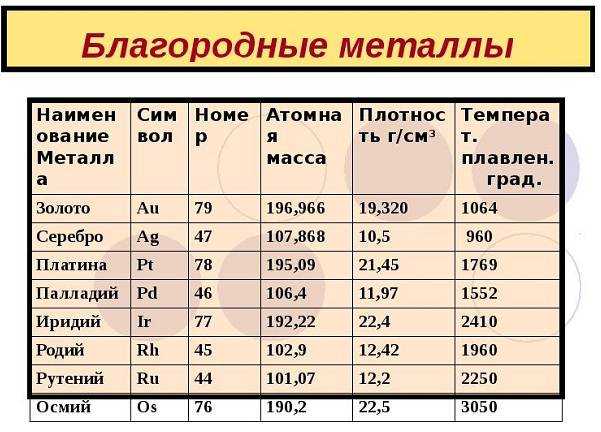
Список благородных металлов
Классификация драгоценных металлов может выполняться по различным критериям. В большинстве случаев разделяют основные металлы, такие как золото, серебро и платина, а также их группы, включающие в себя различные типы и производные. Список благородных металлов включает в себя:
- золото(Аu), а также все 10 типов этого металла;
- серебро(Ag) имеющее 5 основных разновидностей;
- платина(Pt), сюда подключаются металлы платиновой группы(рутений(Ru), родий(Rh), палладий(Pd), осмий(Os), иридий(Ir) и рений (Re)) сопутствующие ей в природе.
На страницах данного ресурса используется классификация драгоценных металлов по группам, которая доступна в карте сайта.
Золото и серебро называют валютными металлами. Список благородных металлов не всегда был таким. К примеру, платину обнаружили лишь в 16 веке испанские колонизаторы, а в XVIII дали научное описание этому металлу. А палладий, родий, иридий и осмий открыли только в XIX веке.
Виды благородных металлов
 В отличие от валютных металлов, таких как золото и серебро, существуют также виды благородных металлов, которые занимают достойное место под названием благородные металлы. Среди них:
В отличие от валютных металлов, таких как золото и серебро, существуют также виды благородных металлов, которые занимают достойное место под названием благородные металлы. Среди них:
- платина (Pt),
- осмий (Os),
- иридий (Ir),
- рутений (Ru),
- палладий (Pd),
- родий (Rh).
Так родий занимает первое место по своей ценности, кроме того он значительно дороже золота. Этот металл серебристого цвета с голубоватым оттенком, был открыт в 1803 г. Его стоимость приблизительно равна эквиваленту в валюте США $230/1 грамм. Родий очень хрупкий, великолепно устойчив к воздействиям агрессивной среды и высокой температуры.
Платина занимает второе место по ценности. Этот химический элемент появился в 1952 году. По причине повышенной химической стойкости, на платину не действует ни одна отдельно взятая кислота. Она не окисляется на воздухе и не изменяет свой цвет при сильном накаливании.
Осмий — редкий благородный металл, очень дорогостоящий, является самым тяжелым драгоценным металлом, очень хрупкий, исключительно твердый.
Иридий, и рутений содержат почти одинаковые свойства — хрупкость, повышенная твердость, достаточно редкие.
Палладий – легкий, драгоценный металл, более доступен, чем другие платиновые металлы. Он пластичный, достаточно гибкий, стойкий к коррозии, легкоплавкий.
Все виды благородных металлов нашли широкое применение в некоторых деталях автомобильных катализаторов, фильтров нейтрализаторов, микроэлектронике, атомной промышленности, стоматологии, химическом, нефтехимическом производстве, биомедицине, аэрокосмическом приборостроении и военной промышленности.
Благородные металлы тесно вошли в жизнь каждого современного человека. Даже если вы не носите ювелирных украшений — все равно вы всегда держите благородные металлы под рукой. Как это понять?) Очень просто! В любом современном электронном устройстве (телефон, компьютер, чипы автомобильной электроники, и т.д.) — содержаться драгоценные металлы. Поэтому даже если сами по себе ювелирные изделия не интересны — знать как выглядит белое золото /платина / серебро и другие благородные металлы всё-таки стоит. Ведь обидно будет потерять деньги, выбросив в мусорное казалось бы ненужную старую деталь (например лампу старого телевизора — в ней может содержаться не мало серебра и даже присутствовать золото).
Рубрика содержит описания и список благородных металлов, их разновидностей, сплавов, физических свойств и химических характеристик. Отдельные статьи посвящены описаниям конкретных металлов и их сплавов.
Также в статьях рубрики собраны фото и таблицы с основными техническими характеристиками материалов.
Надеемся контент рубрики «Благородные металлы» будет полезен в решении ваших задач и вопросов.
Список химических элементов Таблицы Менделеева
Список химических элементов упорядочен в порядке возрастания атомных номеров, приводятся обозначения элемента в Таблице Менделеева, латинское и русское названия.
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннесин |
| 118 | Og | Oganesson | Оганессон |
Что это такое?
Благородные металлы от других элементов отличает способность сохранять молекулярную структуру под воздействием неблагоприятной среды. Они не поддаются разложению, а температура плавления этих элементов крайне велика. Не вступают в реакцию с кислородом и не производят оксидов. Получить сплавы с драгметаллами можно только путем сложных химических манипуляций с использованием сильнейших реактивов.
Массовая доля благородных металлов от общей добычи природных ископаемых очень незначительна, чем и объясняется высокая цена этих элементов, а также их особый статус.
Инертные (благородные) газы
Группа VIII(18). Атомы элементов этой группы имеют полностью «укомплектованный» внешний электронный слой. Поэтому им «не надо» принимать электроны. И отдавать их они «не хотят». Отсюда — элементы этой группы очень «неохотно» вступают в химические реакции. Долгое время считалось, что они вообще не вступают в реакции (отсюда и название «инертный», т.е. «бездействующий»). Но химик Нейл Барлетт открыл, что некоторые из этих газов при определенных условиях все же могут вступать в реакции с другими элементами.
Электронные конфигурации:
- Ne — 1s22s22p6;
- Ar — 1s22s22p63s23p6;
- Kr — 1s22s22p63s23p64s23d104p6
Подробнее об инертных (благородных) газах см. Атомы элементов 0 группы: общая характеристика…
Характеристики
Золото
Это самый ценный и наиболее распространенный драгоценный металл, о котором упоминают справочники. Оно бывает в виде самородков, песка, примесей руд и сочетаний с другими химическими элементами (электрум).
Золото характеризуется уникальными свойствами, которые позволяют отличать его от других элементов. У него низкое сопротивление, поэтому оно имеет хорошую электропроводность и большую теплопроводность. Золото является пластичным, поэтому поддается всем видам обработки. Оно плотное (19,32 г/см3) и из-за этого имеет тяжелый вес. По прочности и устойчивости к агрессивным веществам, золото уступает многим элементам. В таблице Менделеева золото (Au) расположено на 79 месте. Металлу характерен желтый цвет, а температура плавления составляет 1064С. Этот элемент может раствориться в азотной и хлорной кислотах.
Серебро
Это драгоценный металл блестящего белого цвета. В таблице Менделеева он расположен на 47 месте. Добывают серебро из руды, в которой содержится менее 50% самого драгметалла.

Серебро (Ag) мягкое (плотность 10,5 г/см3) и пластичное, поэтому поддается всем видам обработки, а также оно постепенно окисляется на воздухе.
Серебро подвержено воздействию агрессивных веществ, в результате чего чернеет. Оно имеет небольшое электрическое сопротивлением, поэтому у него хорошая электропроводность и теплопроводность. А также серебро обладает хорошей отражающей способностью. Температура плавления серебра —, 961,9С.
Платина
Второе место по ценности занимает Платина (Pt). Она содержится в качестве примесей в рудах других металлов. Впервые о ней узнали во времена, когда Колумб открыл Америку. Процесс её получения трудоёмкий и затратный. Главной особенностью платины является высокая стойкость к агрессивным веществам, поэтому она не боится кислот. Даже в процессе накаливания она не окисляется и не меняет природного белого цвета.
Подробную информацию о драгметалле можно получить в специализированном справочнике.
Палладий
Согласно справочникам, палладий (Pd) — лёгкий металл, его плотность —, 12,02 г/м3. Он содержится как примесь в медных и никелевых рудах, что делает его наиболее доступным среди остальных элементов платиновой группы.
Главными особенностями палладия являются: пластичность, устойчивость к коррозии, поглощение водорода. Температура плавления 1552С. В таблице Менделеева палладий располагается на 46 месте. Металл поддается обработке и полировке и сохраняет свой белый цвет на длительный срок.
Родий
По мнению большинства, золото самый дорогой и благородный металл. Это не так, потому что существуют еще более дорогие элементы, например, Родий (Rh). У родия цвет серебра, с голубым отливом. Он является тугоплавким (плавится при 1960С). Цена грамма родия колеблется в промежутке от 200 до 230$, поэтому его используют там, где с поставленной задачей не могут справиться остальные элементы. Высокая цена родия сформирована из-за того, что этот элемент очень редкий.

У этого металла хорошая устойчивость к агрессивным веществам. Плотность родия 12,42 г/м3 —, это меньше, чем у остальных элементов платиновой группы. Им чаще всего покрывают другие материалы, чтобы повысить их эксплуатационные характеристики, потому что родий обладает хорошей отражающей способностью, не боится воды и кислот. Согласно справочникам, растворить родий могут только щелочные смеси цианидов.
Рутений
Рутений (Ru) назвали в честь России, так как именно здесь его открыли. Рутений относится к редким элементам. Металл обладает большой тугоплавкостью (плавится при 2950С), химической устойчивостью, твердостью и другими ценными характеристиками. Кроме того, рутений имеет отличные каталитические свойства. Основным недостатком является хрупкость.
В таблице Менделеева рутений размещается на 44 месте. Этому металлу свойственен белый цвет с серебристым отливом, поэтому он очень похож на платину.
Иридий
Это плотный тяжелый металл (22,42 г/м3). К тому же обладает высокой твёрдостью, из-за чего возникают проблемы с его обработкой. В природе иридий встречается очень редко. Он очень прочный, но в то же время хрупкий.
В таблице Менделеева иридий (Ir) размещается на 77 месте. Характерные отличия иридия — это серебристо-белый цвет с серым оттенком и высокая тугоплавкость (плавится при 2450С). Не поддается воздействию агрессивных веществ.
Осмий
Этот элемент является очень редким, в чистом виде его не найти. Редкость — это основная причина высокой стоимости осмия, в результате чего его используют очень мало. Подробнее о редком металле можно узнать из справочника.
Нахождение в природе
Среднее содержание серебра в земной коре (по Виноградову) — 70 мг/т. Максимальные его концентрации устанавливаются в глинистых сланцах, где достигают 1 г/т. Серебро характеризуется относительно низким энергетическим показателем ионов, что обуславливает незначительное проявление изоморфизма этого элемента и сравнительно трудное его вхождение в решётку других минералов. Наблюдается лишь постоянный изоморфизм ионов серебра и свинца. Ионы серебра входят в решётку самородного золота, количество которого иногда достигает в электруме почти 50 % по массе. В небольшом количестве ион серебра входит в решётку сульфидов и сульфосолей меди, а также в состав теллуридов, развитых в некоторых полиметаллических и особенно, в золото-сульфидных и золото-кварцевых месторождениях.
Определённая часть благородных и цветных металлов встречается в природе в самородной форме. Известны и документально подтверждены факты нахождения не просто больших, а огромных самородков серебра. Так, например, в 1477 году на руднике «Святой Георгий» (месторождение Шнееберг в Рудных горах в 40—45 км от города Фрайберг) был обнаружен самородок серебра весом 20 т. Глыбу серебра размером 1×1×2,2 м выволокли из горной выработки, устроили на ней праздничный обед, а затем раскололи и взвесили. В Дании, в музее Копенгагена, находится самородок весом 254 кг, обнаруженный в 1666 году на норвежском руднике Конгсберг. Крупные самородки обнаруживали и на других континентах. В настоящее время в здании парламента Канады хранится одна из добытых на месторождении Кобальт в Канаде самородных пластин серебра, имеющая вес 612 кг. Другая пластина, найденная на том же месторождении и получившая за свои размеры название «серебряный тротуар», имела длину около 30 м и содержала 20 т серебра. Однако, при всей внушительности когда-либо обнаруженных находок, следует отметить, что серебро химически более активно, чем золото, и по этой причине реже встречается в природе в самородном виде. По этой же причине растворимость серебра выше и его концентрация в морской воде на порядок больше, чем у золота (около 0,04 мкг/л и 0,004 мкг/л соответственно).
Руда серебра, Приморье
Известно более 50 природных минералов серебра, из которых важное промышленное значение имеют лишь 15—20, в том числе:
- самородное серебро;
- электрум (золото-серебро);
- кюстелит (серебро-золото);
- аргентит (серебро-сера);
- прустит (серебро-мышьяк-сера);
- бромаргерит (серебро-бром);
- кераргирит (серебро-хлор);
- пираргирит (серебро-сурьма-сера);
- стефанит (серебро-сурьма-сера);
- полибазит (серебро-медь-сурьма-сера);
- фрейбергит (медь-сера-серебро);
- аргентоярозит (серебро-железо-сера);
- дискразит (серебро-сурьма);
- агвиларит (серебро-селен-сера)
Как и другим благородным металлам, серебру свойственны два типа проявлений:
- собственно серебряные месторождения, где оно составляет более 50 % стоимости всех полезных компонентов;
- комплексные серебросодержащие месторождения (в которых серебро входит в состав руд цветных, легирующих и благородных металлов в качестве попутного компонента).
Собственно серебряные месторождения играют достаточно существенную роль в мировой добыче серебра, однако следует отметить, что основные разведанные запасы серебра (75 %) приходятся на долю комплексных месторождений.
Содержание серебра в рудах цветных металлов 10-100 г/т, в золото-серебряных рудах 200—1000 г/т, а в рудах серебряных месторождений 900—2000 г/т, иногда десятки килограммов на тонну.
Серебро встречается и в каустоболитах: торфах, нефти, угле, битуминозных сланцах.
Месторождения
Производство серебра по странам (2011 год)
Значительные месторождения серебра расположены на территориях следующих стран:
- Армении,
- Германии,
- Испании,
- Перу,
- Чили,
- Мексики,
- Китая,
- Канады,
- США,
- Австралии,
- Польши,
- России,
- Казахстана,
- Румынии,
- Швеции,
- Чехии,
- Словакии,
- Австрии,
- Венгрии,
- Норвегии.
Также месторождения серебра есть на Кипре и на Сардинии.